近期,国家医保局发布了《关于政协十三届全国委员会第五次会议第03270号(社会管理类306号)提案答复的函》(以下简称《答复》)。 支持国产医疗器械药监局认真贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》和中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,积极推进医疗器械审评审批制度改革工作。2014 年发布《创新医疗器械特别审批程序(试行)》,2018年经修改完善后发布《创新医疗器械特别审查程序》,针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。相关部门按照早期介入、专人负责、全程指导的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人沟通交流。2016 年发布《医疗器械优先审批程序》,对列入国家科技重大专项或者重点研发计划的医疗器械、诊断或治疗罕见病、恶性肿瘤、老年人特有和多发疾病、专用于儿童的医疗器械以及临床急需医疗器械予以优先审批,促进此类产品尽快上市。《创新医疗器械特别审批程序(试行)》和《医疗器械优先审批程序》,对于鼓励医疗器械产业创新,促进临床急需的医疗器械尽快上市发挥了重要作用。符合条件的相关医疗器械可以申请按相应程序加快审批。创新医疗器械加速发展早在2015年8月,《国务院关于改革药品医疗器械审评审批制度的意见》发布,新一轮审评审批制度改革正式拉开帷幕,一系列优化审评程序、鼓励创新的举措快速推进,全面激发产业创新活力。在降本控费的大环境下,政策为创新医疗器械亮起的绿灯一直未灭,从加快审批、纳入医保、CHS-DRG付费新药新技术除外支付、不纳入集采等几个方面对其加予支持。在国家医保局对十三届全国人大五次会议第8013号建议的答复中,也明确提到:在推进医保支付方式改革,确定按疾病诊断相关分组(CHS-DRG)、按病种分值付费(DIP)支付标准等环节,对创新医用耗材等按相关规定和程序予以支持。同时,在集中带量采购之外留出一定市场,为创新产品开拓市场提供空间。2022年7月13日,北京市医保局发布《关于引发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》,明确试行CHS-DRG付费新药新技术除外支付管理办法。有利于创新医疗器械获得更合理的收益,加速产品放量。合壹汇医疗观点截至2023年1月5日,2022年国家局公示了67个三类医疗器械进入创新审批绿色通道(见表一),54个三类创新器械获批上市(见表二)。表一:
支持国产医疗器械药监局认真贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》和中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,积极推进医疗器械审评审批制度改革工作。2014 年发布《创新医疗器械特别审批程序(试行)》,2018年经修改完善后发布《创新医疗器械特别审查程序》,针对具有我国发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。相关部门按照早期介入、专人负责、全程指导的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人沟通交流。2016 年发布《医疗器械优先审批程序》,对列入国家科技重大专项或者重点研发计划的医疗器械、诊断或治疗罕见病、恶性肿瘤、老年人特有和多发疾病、专用于儿童的医疗器械以及临床急需医疗器械予以优先审批,促进此类产品尽快上市。《创新医疗器械特别审批程序(试行)》和《医疗器械优先审批程序》,对于鼓励医疗器械产业创新,促进临床急需的医疗器械尽快上市发挥了重要作用。符合条件的相关医疗器械可以申请按相应程序加快审批。创新医疗器械加速发展早在2015年8月,《国务院关于改革药品医疗器械审评审批制度的意见》发布,新一轮审评审批制度改革正式拉开帷幕,一系列优化审评程序、鼓励创新的举措快速推进,全面激发产业创新活力。在降本控费的大环境下,政策为创新医疗器械亮起的绿灯一直未灭,从加快审批、纳入医保、CHS-DRG付费新药新技术除外支付、不纳入集采等几个方面对其加予支持。在国家医保局对十三届全国人大五次会议第8013号建议的答复中,也明确提到:在推进医保支付方式改革,确定按疾病诊断相关分组(CHS-DRG)、按病种分值付费(DIP)支付标准等环节,对创新医用耗材等按相关规定和程序予以支持。同时,在集中带量采购之外留出一定市场,为创新产品开拓市场提供空间。2022年7月13日,北京市医保局发布《关于引发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》,明确试行CHS-DRG付费新药新技术除外支付管理办法。有利于创新医疗器械获得更合理的收益,加速产品放量。合壹汇医疗观点截至2023年1月5日,2022年国家局公示了67个三类医疗器械进入创新审批绿色通道(见表一),54个三类创新器械获批上市(见表二)。表一: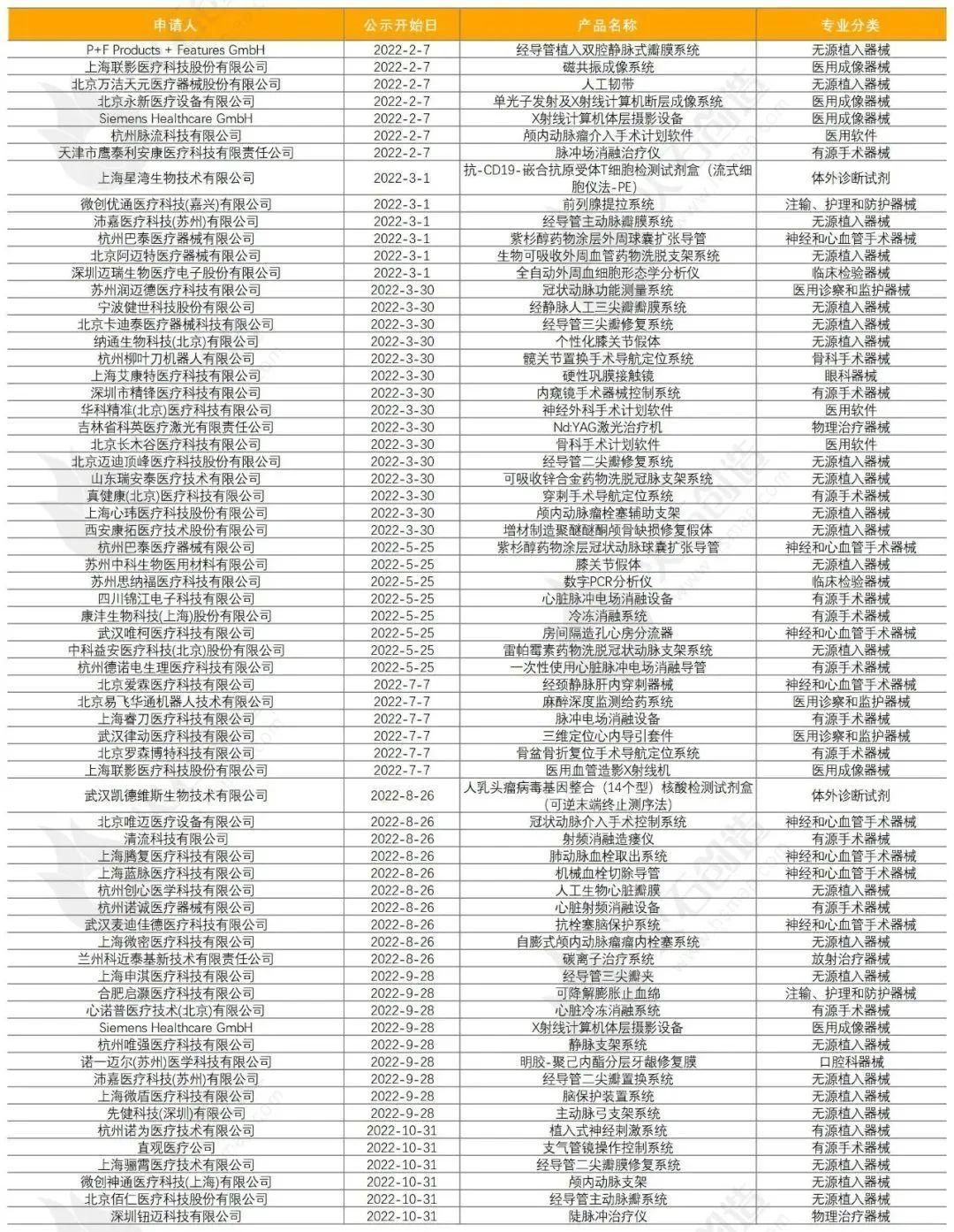 表二:
表二: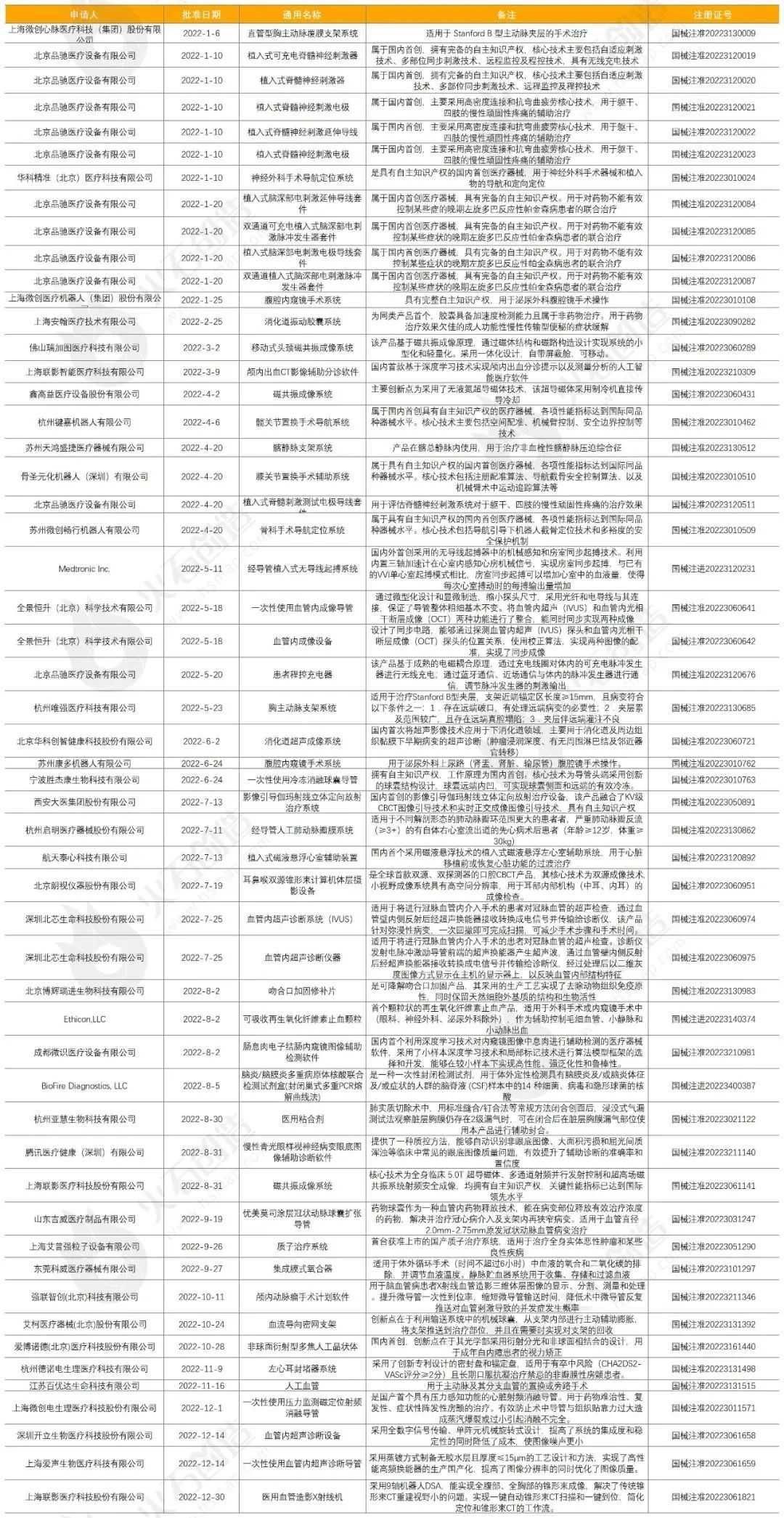 随着医疗器械审评审批制度改革的纵深推进,国产高端影像设备、人工智能医疗器械等一批国际领先的创新产品获准上市,国产创新器械的步伐正不断加快。免责声明:本文为合壹汇医疗原创整理,资料综合来源国家医保局、赛柏蓝器械、中国医药报,相关版权归原作者所有,如有侵权,请联系我方处理。
随着医疗器械审评审批制度改革的纵深推进,国产高端影像设备、人工智能医疗器械等一批国际领先的创新产品获准上市,国产创新器械的步伐正不断加快。免责声明:本文为合壹汇医疗原创整理,资料综合来源国家医保局、赛柏蓝器械、中国医药报,相关版权归原作者所有,如有侵权,请联系我方处理。